Contaminación del aire.
Es la que se produce como consecuencia de la emisión de sustancias tóxicas. La contaminación del aire puede causar trastornos tales como ardor en los ojos y en la nariz, irritación y picazón de la garganta y problemas respiratorios. Bajo determinadas circunstancias, algunas substancias químicas que se hallan en el aire contaminado pueden producir cáncer, malformaciones congénitas, daños cerebrales y trastornos del sistema nervioso, así como lesiones pulmonares y de las vías respiratorias. A determinado nivel de concentración y después de cierto tiempo de exposición, ciertos contaminantes del aire son sumamente peligrosos y pueden causar serios trastornos e incluso la muerte.
La polución del aire también provoca daños en el medio ambiente, habiendo afectado la flora arbórea, la fauna y los lagos. La contaminación también ha reducido el espesor de la capa de ozono. Además, produce el deterioro de edificios, monumentos, estatuas y otras estructuras.
La contaminación del aire también es causante de neblina, la cual reduce la visibilidad en los parques nacionales y otros lugares y, en ocasiones, constituye un obstáculo para la aviación.
La contaminación del aire es uno de los primeros problemas de esta índole que nos afectan ya que sin beber o comer podemos estar días pero sin respirar por lo general apenas 4 minutos. El aire está compuesto en un 78% de nitrógeno y un 21% de oxígeno, 0,093 de argón y el resto de vapor de agua. Y esto es lo que los seres aeróbicos (que necesitan oxígeno para existir) precisan para vivir.
Cuando estos elementos se ven alterados por la mano del hombre (contaminación por fábricas, vehículos de explosión, etc.) o por causas naturales (erupciones volcánicas, tormentas de polvo, etc.) se produce la contaminación del aire.
Generalmente la mayor causa suele ser la que viene de origen humano y no sólo de las grandes fábricas, también el ciudadano de a pie puede hacer algo al respecto.
El calentamiento de la tierra debido a la emisión de CO2.
Dentro de un invernadero la temperatura es más alta que en el exterior porque entra más energía de la que sale, por la misma estructura del habitáculo, sin necesidad de que empleemos calefacción para calentarlo.
En el conjunto de la Tierra de produce un efecto natural similar de retención del calor gracias a algunos gases atmosféricos. La temperatura media en la Tierra es de unos 15ºC y si la atmósfera no existiera sería de unos -18ºC. Se le llama efecto invernadero por similitud, porque en realidad la acción física por la que se produce es totalmente distinta a la que sucede en el invernadero de plantas. El efecto invernadero se origina porque la energía que llega del sol, al proceder de un cuerpo de muy elevada temperatura, está formada por ondas de frecuencias altas que traspasan la atmósfera con gran facilidad. La energía remitida hacia el exterior, desde la Tierra, al proceder de un cuerpo mucho más frío, está en forma de ondas de frecuencias mas bajas, y es absorbida por los gases con efecto invernadero. Esta retención de la energía hace que la temperatura sea más alta, aunque hay que entender bien que, al final, en condiciones normales, es igual la cantidad de energía que llega a la Tierra que la que esta emite. Si no fuera así, la temperatura de nuestro planeta habría ido aumentando continuamente, cosa que, por fortuna, no ha sucedido.
Podríamos decir, de una forma muy simplificada, que el efecto invernadero lo que hace es provocar que le energía que llega a la Tierra sea "devuelta" más lentamente, por lo que es "mantenida" más tiempo junto a la superficie y así se mantiene la elevación de temperatura.
Para más información sobre este tema, con datos y gráficos ver la página subordinada: "Balance de energía en la Tierra y efecto invernadero"
En el último siglo la concentración de anhídrido carbónico y otros gases invernadero en la atmósfera ha ido creciendo constantemente debido a la actividad humana:
A comienzos de siglo por la quema de grandes masas de vegetación para ampliar las tierras de cultivo
En los últimos decenios, por el uso masivo de combustibles fósiles como el petróleo, carbón y gas natural, para obtener energía y por los procesos industriales.
Las principales fuentes emisoras de CO2 y la contribución de los países industrializados a la emisión de este compuesto.
El total de carbono emitido en el siglo pasado a partir de la quema de combustibles fósiles fue de 261,233 millones de toneladas, en las que 19 países contribuyeron con 82.8% de las emisiones, y el resto del mundo contribuyó con el 17.2%.
México emitió 2,627 millones de toneladas de carbono que corresponden al 1% de las emisiones totales durante el período considerado (1900-2000), ubicándose en la posición número 15, junto con la ahora República Checa y Bélgica cuyas emisiones fueron similares.
Estados Unidos y Europa Occidental han contribuido de manera similar a las emisiones totales durante el último siglo. En la gráfica 6 se presentan las emisiones de ambas regiones y su comportamiento a partir de 1900.
Por otro lado, los índices de emisión per cápita han sido más altos históricamente para Estados Unidos que para Europa Occidental (gráfica 7). En el primer caso se han mantenido en valores de 5 toneladas de carbono por habitante por año, en promedio, y en el caso de Europa Occidental estos.
En las nueve regiones consideradas existen ciertos países que tienen mayor contribución; tal es el caso de Estados Unidos, que aporta 92.6% de la región de Norteamérica. En Asia, China aporta 92.6% de las emisiones de esta región y es el principal productor de carbón y cemento en el mundo. En Europa del Este influyen Rusia y Ucrania. En el Lejano Oriente 56.5% de las emisiones de la región son aportadas por la India y Corea del Sur, en tanto que Indonesia, Taiwán, Tailandia, Pakistán, Malasia, Singapur y Filipinas contribuyen con 40% (Marlan et.al. 2003).
En Europa Occidental dominan Alemania, Reino Unido, Italia, Francia y España, los cuales contribuyen con 74% de las emisiones de la región. Alemania es el segundo país importador de gas natural y el cuarto de crudo. En Oceanía, Japón y Australia contribuyen con 97% de las emisiones. Japón es el principal país importador de carbón y gas licuado en el mundo, el segundo de crudo y el tercero de gas natural.
En la región de Centro y Sudamérica, México y Brasil contribuyen con 51.6% de las emisiones; México contribuye con 98 de las 359 millones de toneladas de carbono que se emiten en la región. Otros países que emiten más de 10 millones de toneladas de carbono son: Venezuela (34.3), Argentina (37.6), Colombia (17.4) y Chile (17.1).
Principales fuentes emisoras de contaminantes.
Las principales cusas de contaminación del aire de origen humano son la industria y el transporte. Según datos oficiales, el transporte público de personas, de carga y particulares produce el 80 % de los contaminantes a la atmósfera, el 3% la industria y el 10% restante el comercio y los servicios.
El consumo diario de combustible es de unos 43 millones de litros de combustible al día. Existen unos 3.5 millones de coches de motor de explosión circulando diariamente.
Los principales contaminantes de los vehículos de combustibles fósiles y que afectan la salud son:
El monóxido de carbono: Expulsado por la combustión parcial en los motores de los vehículos de gasolina.
Los hidrocarburos: Producidos por componentes de la gasolina y otros derivados del petróleo.
El plomo: Usado como aditivo de combustibles, es antidetonante para gasolina
Los principales contaminantes del aire son:
Gases Tóxicos.
•Monóxido de Carbono: Es producido por la combustión de la gasolina en vehículos automotores.
•Sulfuros y oxido de nitrógeno: Es uno de los más provenientes de la combustión del carbón, del petróleo y otros combustibles.
•Humo: Es producido por la combustión incompleta de materiales de desechos, basura y del consumo de cigarrillos.
•Compuesto de Plomo: Es proveniente de la gasolina; del proceso de reciclaje de plomo y de su utilización en la fabricación de baterías y en la industria telefónica.
•Vapores de Mercurio: Es utilizada en la fabricación de lámparas fluorescentes, laboratorios odontológicos y fabricas de termómetros.
•Cadmio: Son los gases de este metal que provienen de su utilización en la fabricación de baterías, pintura, caucho y como aditivo para el tabaco.
Aerosoles.
•Clorofluorocarbono: Son productos químicos que se utilizan como propelentes en aerosoles y sistema de refrigeración. Estas sustancias provoca disminución de la capa de ozono, la cual filtra los rayos ultravioleta de la luz solar.
•Polvo Orgánico: Es proveniente de la textilera.
•Partículas de sílice: Es proveniente de la pulverización de rocas y de la fabricas de cementos ladrillos y vidrios.
El ozono, su formación en la atmosfera como resultado de la combustión de hidrocarburos. Su efecto sobre la salud.
El ozono es un gas con un olor penetrante ácrido, componente principal de la niebla y el humo contaminante. El ozono existe en el ambiente debido a la interacción de la luz ultravioleta (luz solar) con un grupo de contaminantes del aire llamados óxidos de nitrógeno. El ozono atmosférico superior actúa como protección a los efectos perjudiciales de la luz solar a la tierra, y no debe ser confundido con el ozono a nivel de suelo, considerado una forma más peligrosa de contaminación del aire. El nivel usual de ozono a nivel del suelo es normalmente menos de 0.05 partes por millon (ppm). Algunas fuentes que contribuyen al nivel de ozono tanto a nivel del suelo como en la atmosfera superior, cuando interactúan con la luz del sol, son los compuestos volátiles orgánicos (CVO) tal como los hidrocarburos que se encuentran en el escape de automoviles, petroleo refinado, la gasolina, y materiales de lavado en seco.
El ozono es un irritante respiratorio. Los síntomas incluyen falta de aliento, dolor de pecho cuando se respira profundamente, respiración silbante, y tos. Los individuos jovenes y saludables pueden experimentar problemas tales como decremento de la función pulmonar cuando se ejercitan (tal como durante el ejercicio pesado) cuando los niveles de ozono se elevan. Hay evidencia de que los cambios en la función pulmonar experimentados cuando los niveles de ozono se elevan pueden persistir para varios dias despues la exposición.
La exposición a concentraciones elevadas de ozono en el aire a nuestro alrededor (ambiente) ha sido responsabilizada del aumento en admisiones hospitalarias debido a problemas respiratorios, tal como el asma. La exposición repetida a ozono puede hacer a la gente más susceptible a infecciones respiratorias y a inflamación pulmonar, y puede agravar enfermedades respiratorias pre-existentes. Recientemente, la atención se ha empezado a enfocar en los efectos a largo plazo y a exposiciones repetidas a altos niveles de ozono.
La Agencia de Protección Ambiental de EEUU (APA, siglas EPA en Inglés) ha identificado tres grupos de gente quienes puede estar en riesgo particular cuando se exponen a altos niveles de ozono:
•Gente con enfermedad respiratoria pre-existente (i.e., bronquitis crónica, enfisema, asma) no puede tolerar una reducción adicional en la función pulmonar debido a exposición al ozono.
•Una porción (5% a 20%) del total de la población de U.S.A. es llamada "reactores." Esta gente reacciona a la exposición con ozono mientras hacen ejercicio con perdidas significativamente mayores en la función pulmonar que la persona promedio. Actualmente, no hay forma para identificar a estos "reactores" antes de la exposición al ozono.
•Los individuos quienes hacen ejercicio al aire libre ó participan en actividades al aire libre que aumenta su proporción respiratoria responden mucho más severamente a la exposición con ozono que gente en descanso.
Formación natural del ozono. La capa protectora de ozono y su función en la preservación de la vida.
"La química del cloro puede tener un impacto directo en el ozono de la superficie, incluso con valores de algunas partes por billón", advierte Eric Saltzman, profesor de ciencias de los sistemas terrestres en la Escuela de Ciencias Físicas de la UCI. "Debido a la fuerte relación entre el ozono y la salud humana, necesitamos conocer a fondo el papel que el cloro puede desempeñar en la química del ozono en los ambientes urbanos costeros".De modo natural, por acción de los vientos, las sales de cloro están presentes en los aerosoles de sales marinas contenidos en el aire costero. También se usa el cloro gaseoso para tratar el agua en las piscinas de natación, torres de refrigeración y en los suministros de agua municipales. Los átomos de cloro reaccionan rápidamente con los hidrocarburos y óxidos de nitrógeno de las emisiones provenientes de automóviles y de plantas de generación de energía eléctrica, contribuyendo a la compleja cadena de reacciones que llevan a la formación del ozono. La causa primaria del ozono urbano es la reacción del radical hidroxilo con los hidrocarburos y los óxidos de nitrógeno. El radical hidroxilo es una molécula muy reactiva formada por oxígeno e hidrógeno que se produce por vía fotoquímica en el aire.
•Se denomina capa de ozono, u ozonosfera, a la zona de la estratosfera terrestre que contiene una concentración relativamente alta de ozono, gas compuesto por tres átomos de oxígeno (O3). "Relativamente alta" quiere decir unas pocas partículas por millón, mucho más alta que las concentraciones en la atmósfera baja pero aún pequeña comparada con la concentración de los principales componentes de la atmósfera.
•La capa de ozono fue descubierta en 1913 por los físicos franceses Charles Fabry y Henri Buisson. Sus propiedades fueron examinadas en detalle por el meteorólogo británico G.M.B. Dobson, quien desarrolló un sencillo espectrofotómetro que podía ser usado para medir el ozono estratosférico desde la superficie terrestre. •La existencia de la Capa de Ozono es capital para la preservación de la vida en nuestro planeta. Así, el 03 forma un escudo protector que impide que los rayos (UV) perjudiciales del Sol alcancen la faz de la Tierra, dejando, por el contrario, continuar su camino hacia la superficie los rayos (UV) benéficos (luz solar iniciadora del proceso fotosintético en los vegetales de la tierra y del mar).
•En la estratosfera, a una distancia entre 15 y 50 kilómetro, forma una verdadera capa protectora de los rayos ultravioletas provenientes del sol, ya que actúa como una pantalla que filtra dichos rayos; por lo que ésta es, indudablemente su función especifica en la estratosfera, que es donde se encuentra en estado natural y es allí donde absorbe las peligrosas radiaciones ultravioletas provenientes del sol, mientras que deja pasar la luz visible para soportar la producción de las plantas que forman la base de las cadenas alimenticias.
La oxidación de las impurezas de los combustibles derivados del petróleo, formación de SO2 , SO3 , y H2SO4 , la lluvia acida , sus efectos sobre el medio y los seres vivos.
Se trata de una reacción de oxidación con la particularidad de que se realiza muy rápidamente, es exotérmica. Esta reacción se produce entre los elementos combustibles de un combustible y el oxígeno del comburente. Para que un combustible sufra la combustión, es necesario que alcance su temperatura de ignición. Se define el punto de ignición de un combustible como la temperatura a la cual, una vez iniciada la llama, esta ya no se extingue. Es esta temperatura de 20 a 60ºC más alta que la temperatura de inflamación.
En una reacción de oxidacción tendremos Primer Miembro Segundo Miembro
Combustible + comburente Gases de combustión + calor
Combustible: Toda sustancia capaz de arder
Comburente: Sustancia que aporta el oxígeno para que el combustible sufra oxidación
Los combustibles industriales suelen estar constituídos por mezclas de pocos elementos, ya que esto simplifica en gran medida el proceso. Los componentes de un combustible se pueden clasificar en:
Combustibles
Inertes. Estos hay que eliminarlos y por lo tanto resultan perjudiciales
FORMACION DEL SO2: El dióxido de Azufre (So2) es un contaminante primario que se produce en la combustión de carbón y petróleo que contienen azufre:
El SO2 también se produce en la refinación de ciertos minerales que son sulfuros.
La Naturaleza también hace su aporte de dicho óxido a través de las erupciones volcánicas y cierto tipo de fuentes termales. El dióxido de azufre se oxida transformándose a trióxido a través de varios procesos. Uno de ellos es combinándose con el ozono presente en la atmósfera:
Otro proceso es combinándose con el oxígeno atmosférico actuando como catalizador las partículas sólidas suspendidas en el aire:
FORMACION DEL H2SO4: Este último óxido reacciona con el agua de la lluvia, generándose ácido sulfúrico, el cual forma parte de la lluvia ácida.
Este ácido ataca las construcciones realizadas en piedra caliza y mármol, siendo la reacción:
A su vez, el dióxido de azufre presente en la atmósfera puede atacar directamente al mármol según la reacción:
FORMACION DEL SO3: El óxido de azufre (VI) o trióxido de azufre (SO3) es en condiciones normales un sólido incoloro de textura fibrosa, pero en condiciones estándar (a 25ºC y 1 atm) es un gas, un contaminante importante, siendo el principal agente de la lluvia ácida.
Es el producto de la oxidación del óxido de azufre (IV) con oxígeno en presencia de un catalizador como el pentóxido de vanadio o de platino. Es producido a gran escala como precursor del ácido sulfúrico.
En presencia de agua reacciona violentamente dando lugar a la formación de ácido sulfúrico, haciendo que sea altamente corrosivo. El SO3 es el anhídrido ácido del H2SO4, de manera que se produce la siguiente reacción:
SO3(l) + H2O(l) → H2SO4(l) (+88 kJ mol−1)
La reacción es rápida y exotérmica. Alrededor de 340ºC, el ácido sulfúrico, el óxido de azufre (VI) y el agua coexisten en concentraciones significativas de equilibrio. El óxido de azufre (IV) también reacciona con cloruro de azufre (II) para producir cloruro de tionilo
SO3 + SCl2 → SOCl2 + SO2.
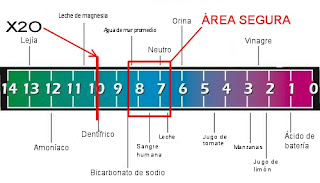
La lluvia acida , sus efectos sobre el medio y los seres vivos.
La lluvia normalmente presenta un potencial de Hidrogeno (pH) de 5.5 a 5.6 -ligeramente ácido-, cuando este valor se reduce a menos de 5 hablamos de lluvia ácida. Esta es generada gracias a las reacciones químicas entre el aire húmedo y gases, derivados de la contaminación atmosférica.
Los gases emitidos por las actividades industriales (fábricas, combustión, centrales eléctricas, etc.) son los causantes de la formación de la lluvia ácida, esta provoca el deterioro del medio ambiente.
Pese a su nombre, la lluvia ácida no siempre es húmeda. Las sustancias que se combinan para formarla pueden también producir un polvo seco e invisible que, al caer en un determinado lugar, daña seriamente el medio ambiente. También se presenta en forma de granizo y nieve.
Este fenómeno fue descubierto en 1872 por un químico inglés llamado Robert Angus Smith, quien se percató de éste fenómeno en las áreas industriales de Inglaterra y le d el nombre de «lluvia ácida»; no obstante, poca fue la atención que recibió su descubrimiento, ahora éste es uno de los temas más tratados a nivel mundial, debido a su repercusión en el medio ambiente. La lluvia ácida tiene una gran cantidad de efectos nocivos en los ecosistemas y sobre los materiales. Al aumentar la acidez de las aguas de ríos y lagos, produce trastornos importantes en la vida acuática .Algunas especies de plantas y animales logran adaptarse a las nuevas condiciones para sobrevivir en la acidez del agua, pero otras no.
Camarones, caracoles y mejillones son las más afectadas por la acidificación del agua. Esta también tiene efectos negativos en peces como el salmón y las truchas. Las huevas y los alevines son los más afectados. Una mayor acidez en el agua puede causar deformaciones en los peces jóvenes y puede evitar la eclosión de las huevas.
La lluvia ácida también aumenta la acidez de los suelos, y esto origina cambios en la composición de los mismos, produciéndose la lixiviación de importantes nutrientes para las plantas (como el calcio) e infiltrando metales tóxicos, tales como el cadmio, níquel, manganeso, plomo, mercurio, que de esta forma se introducen también en las corrientes de agua. La vegetación sufre no sólo las consecuencias del deterioro del suelo, sino también un daño directo por contacto que puede llegar a ocasionar en algunos casos la muerte de la especie. Las construcciones históricas, que se hicieron con piedra caliza, experimentan también los efectos de la lluvia ácida.
EL TIPO DE CONTAMINATES QUE EXISTEN EN EL AIRE DE LA ZONA METROPOLITANA DE LA CD DE MEXICO Y SU PELIGROSIDAD.
El problema de contaminación atmosférica, o contaminación del aire, en México es muy grave. Cinco de las principales ciudades del país presentan altos índices de contaminación, lo que se traduce en una población enferma y vulnerable. Los dos contaminantes de mayor importancia en la Ciudad de México, Ozono y PM10, son los causantes de que miles de mexicanos mueran prematuramente al año por complicaciones de enfermedades respiratorias, así como de innumerables admisiones hospitalarias por problemas respiratorios y cardiovasculares, pérdida de días laborables e ingresos asociados y ausencias escolares. Tan solo en la Ciudad de México, Monterrey, Guadalajara y Toluca, por lo menos 26 millones de habitantes están expuestos frecuentemente a la contaminación en niveles nocivos:
Ozono
Material Particulado (PM)
Todavía no son conocidos en toda su dimensión los efectos a la exposición de largo plazo de las partículas respirables, los compuestos asociados a éstas y otros tóxicos del aire (dióxido de azufre, compuestos orgánicos, etc.).
Por otra parte, en México, al menos el 40% de la población urbana del país vive en ciudades con problemas de contaminación del aire. Además del Valle de México, otras áreas metropolitanas donde se registran niveles de contaminación del aire fuera de las normas de protección a la salud son Guadalajara, Monterrey, Ciudad Juárez, Tijuana, Mexicali, Toluca y Coatzacoalcos. Esto quiere decir que la mitad de los mexicanos somos altamente vulnerables a los efectos del humo, si estamos muy expuestos, si somos niños, ancianos o tenemos alguna enfermedad cardiorrespiratoria.
En el Valle de México se requiere disminuir la contaminación del aire en más de un 50% para cumplir con los límites que establecen las Normas Oficiales Mexicanas para la protección a la salud. Estudios de la Universidad de Harvard, el Banco Mundial y el Sector Salud revelan que podrían evitarse severos efectos a la salud si los niveles actuales de contaminación del aire disminuyeran.
LA CONTRIBUCION DE LA PLANTA INDUSTRIAL DE LA ZONA METROPOLITANA D EMEXICO A LA
CONTAMINACION AMBIENTAL.
Como consecuencia del crecimiento demográfico del Distrito Federal, en la década de 1970 los municipios mexiquenses aledaños al Distrito Federal quedaron conurbados a la zona urbana. Su integración en la zona metropolitana está relacionada con su condición de zonas industriales.
El Distrito Federal y su zona metropolitana han experimentado un proceso de descentralización de la actividad industrial de transformación a partir de los últimos años de la década de 1980.
Este proceso fue estimulado por el gobierno federal en virtud de los peligrosos niveles de contaminación que se alcanzaron en esos años, así como a los problemas urbanos derivados de la alta concentración demográfica que tuvo en la expansión industrial capitalina uno de sus principales incentivos. La mayor parte de la industria se ha trasladado hacia ciudades cercanas como Toluca, Santiago de Querétaro y Puebla de Zaragoza. La descentralización industrial del Distrito Federal ha favorecido el crecimiento de está actividad en otros estados, especialmente los del norte, en donde a partir de la década de 1990 se establecieron nuevas empresas maquiladoras.
Según datos de la Secretaría de Desarrollo Económico del Distrito Federal (Sedeco-DF),[39] la entidad cuenta con cincuenta y cuatro zonas industriales, y de su superficie total, 2.578 ha son destinadas para uso industrial.
La planta industrial de la zona metropolitana de mexico es una de las principales aportadoras para la contaminación ambiental de nuestro país , pero no solo a nuestro país , si no que afecta a nivel mundial siendo otra de tantas que influyen en la contaminación del aire.
Normas Oficiales Mexicanas
Normas para evaluar la calidad del aire como medida de protección a la salud de la población.
Norma Oficial Mexicana NOM-020-SSA1-1993(112K). Salud Ambiental. Criterios para evaluar la calidad del aire ambiente con respecto al ozono (O3)
Norma Oficial Mexicana NOM-021-SSA1-1993(13K). Salud Ambiental. Criterios para evaluar la calidad del aire ambiente con respecto al monóxido de carbono (CO)
Norma Oficial Mexicana NOM-022-SSA1-2010(56K). Salud Ambiental. Criterios para evaluar la calidad del aire ambiente con respecto al bióxido de azufre(SO2)
Norma Oficial Mexicana NOM-023-SSA1-1993(13K). Salud Ambiental. Criterios para evaluar la calidad del aire ambiente con respecto al bióxido de nitrógeno
Normas que establecen los métodos de medición para determinar la concentación del contaminante.
NORMA Oficial Mexicana NOM-034-SEMARNAT-1993 (108K), que establece los métodos de medición para determinar la concentración de monóxido de carbono en el aire ambiente y los procedimientos para la calibración de los equipos de medición.
NORMA Oficial MexicanaNOM-035-SEMARNAT-1993 (161K), que establece los métodos de medición para determinar la concentración de partículas suspendidas totales en el aire ambiente y el procedimiento para la calibración de los equipos de medición.
NORMA Oficial Mexicana NOM-036-SEMARNAT-1993 (165K), que establece los métodos de medición para determinar la concentración de ozono en el aire ambiente y los procedimientos para la calibración de los equipos de medición.
NORMA Oficial Mexicana NOM-037-SEMARNAT-1993 (150k), que establece los métodos de medición para determinar la concentración de bióxido de nitrógeno en el aire ambiente y los procedimientos para la calibración de los equipos de medición.
NORMA Oficial Mexicana NOM-038-SEMARNAT-1993 (182K), que establece los métodos de medición para determinar la concentración de bióxido de azufre en el aire ambiente y los procedimientos para la calibración de los equipos de medición.
Reciente Modificación
Criterio para evaluar la calidad del aire ambiente con respecto a material particulado. Valor de concentración máxima de material particulado para partículas suspendidas totales (PST), partículas menores de 10 micrómetros (PM 10 ) y partículas menores de 2.5 micrómetros (PM 2.5 ) en el aire ambiente como medida de protección a la salud de la población. (NOM-025-SSA1-1993.pdf)
26 de septiembre de 2005 Modificación de la NORMA Oficial Mexicana NOM-025-SSA1-1993, Salud ambiental.
BIBLIOGRAFIAS:
http://www.cemda.org.mx/artman2/publish/Actividades_de_este_programa_75/Derecho_a_un_aire_limpio.php






![\mbox{pH} = -\log_{10} \left[ \mbox{a}_{H_3O^+} \right]](http://upload.wikimedia.org/wikipedia/es/math/7/b/7/7b7e772992e9d43888cd421cba60c766.png)
 , y su unidad es el S/m (
, y su unidad es el S/m ( y la densidad de corriente de conducción
y la densidad de corriente de conducción  :
:
