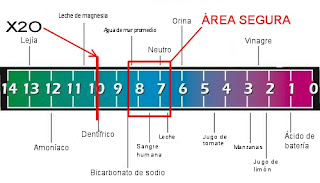
PH:
El pH (potencial de hidrógeno) es una medida de la acidez o alcalinidad de una disolución. El pH indica la concentración de iones hidronio [H3O+] presentes en determinadas sustancias. La sigla significa "potencial de hidrógeno" (pondus Hydrogenii o potentia Hydrogenii; del latín pondus, n. = peso; potentia, f. = potencia; hydrogenium, n. = hidrógeno). Este término fue acuñado por el químico danés Sørensen, quien lo definió como el logaritmo negativo en base 10 de la actividad de los iones hidrógeno. Esto es:
Por ejemplo, una concentración de [H3O+] = 1 × 10–7 M (0,0000001) es simplemente un pH de 7 ya que: pH = –log[10–7] = 7
El pH típicamente va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH menores a 7 (el valor del exponente de la concentración es mayor, porque hay más protones en la disolución) , y alcalinas las que tienen pH mayores a 7. El pH = 7 indica la neutralidad de la disolución (cuando el disolvente es agua).
ACIDOS:
Propiedades de los ácidos
BASES:
Propiedades químicas de las bases Las bases, también llamadas álcalis, fueron caracterizadas, en un principio, por oposición a los ácidos. Eran sustancias que intervenían en aquellas reacciones en las que se conseguía neutralizar la acción de los ácidos. Cuando una base se añade a una disolución ácida elimina o reduce sus propiedades características. Otras propiedades observables de las bases son las siguientes:
- Tienen un sabor amargo característico.
- Al igual que los ácidos, en disolución acuosa conducen la electricidad.
-Colorean de azul el papel de tornasol.
- Reaccionan con los ácidos para formar una sal más agua
- Pierden todas sus propiedades características cuando reaccionan con un ácido
Las propiedades físicas son: casi todos son liquidos, hay algunos solidos y otros gaseosos.
OXIDOS
Un óxido es un compuesto binario que contiene uno o varios átomos de oxígeno (presentando el oxígeno un estado de oxidación -2) y otros elementos. Existe una gran variedad de óxidos, algunos de los cuales pueden encontrarse en estado gaseoso, otros en estado líquido y otros en estado sólido a temperatura ambiente. Casi todos los elementos forman combinaciones estables con oxígeno y muchos en varios estados de oxidación. Debido a esta gran variedad las propiedades son muy diversas y las características del enlace varían desde el típico sólido iónico hasta los enlaces covalentes. Por ejemplo, son óxidos el óxido nítrico (NO) o el dióxido de nitrógeno (NO2). Los óxidos son muy comunes y variados en la corteza terrestre. Los óxidos no metálicos también son llamados anhídridos porque son compuestos que han perdido una molécula de agua dentro de sus moléculas. Por ejemplo, al hidratar anhídrido carbónico en determinadas condiciones puede obtenerse ácido carbónico:
Propiedades generales de los óxidos
El tipo de enlace en los óxidos, EmOn viene determinado por la naturaleza
del elemento E.
Cuando el oxígeno se combina con elementos muy electropositivos,
como los metales de los grupos 1 y 2, la diferencia de electronegatividad χO-
χE, es grande y el enlace entre ambos será fundamentalmente iónico pudiendo
reconocerse en la estructura al ion O-2. Este tipo de óxidos iónicos son sólidos
con elevados puntos de fusión y ebullición.
Li2O, MO (M=Mg, Ca, Sr)
Cuando el oxígeno se combina con elementos no metálicos, y sobre todo
con los muy electronegativos de los grupos 14-17, los enlaces son
fundamentalmente covalentes.
CO2, CO, NO
Cuando el oxígeno se combina con los elementos de electronegatividad
intermedia forma o bien óxidos moleculares o bien poliméricos, siempre con
enlaces de naturaleza covalente.
Al2O3
- Óxidos Metálicos:
Son compuestos con elevado punto de fusión que se forman como consecuencia de la reacción de un metal con él oxigeno. Esta reacción es la que produce la corrosión de los metales al estar expuesto al oxigeno del aire.
Un ejemplo de formación de un óxido metálico es la reacción del magnesio con él oxigeno, la cual ocurre con mayor rapidez cuando se quema una cinta de magnesio. La cinta de magnesio de color grisáceo se torna en un polvo blanco que es el óxido de magnesio. Ecuación:
Magnesio + Oxigeno Óxido de Magnesio
2mg + O2 2mgO
Los Óxidos Metálicos se denominan también Óxidos Básicos por que tiene la propiedad de reaccionar con el aguay formar bases o hidróxidos.
Ejemplo: Óxido de Magnesio + Agua Hidróxido de Magnesio
mgO + H2O mg (OH)2
Las bases se pueden reconocer fácilmente a través de un cambio de color en un indicador acido-básico como el papel tornasol. Las disoluciones básicas tornan el papel tornasol rosado a un color azul al entrar en contacto con ella.
Óxidos No Metálicos u Ácidos:
Los óxidos no metálicos son compuestos de bajos puntos de fusión que se forman al reaccionar un no metal con el oxigeno. Se denominan también anhídridos y muchos de ellos son gaseosos.
Ejemplo: Carbono + Oxigeno Dióxido de Carbono.
C + O2 CO2
Cuando los óxidos metálicos reaccionan con el agua forman ácidos, por lo que se le llaman también óxidos ácidos.
Ejemplo: Dióxido de Carbono + Agua Acido Carbónico
CO2 + H2O H2CO3
Los Ácidos se pueden también reconocer por el cambio de color de un indicador ácido-base como el papel tornasol. Las disoluciones ácidas tornan el papel tornasol azul a un color rosado al entrar en contacto con ella.
Los ácidos producidos por la reacción de los óxidos no metálicos con el agua se denominan Oxácidos debido a que contienen Oxigeno.
- De los hidróxidos:
FÍSICAS: Los hidróxidos son muy corrosivos al tacto con la piel y son resbalosos, dejan huellas de una especie de "baba"; pueden ser muy letales.
QUÍMICAS: La fórmula de los hidróxidos siempre termina en OH por lo que son un valor negativo en la fórmula, son bases (generalmente bases fuertes)
CONDUCTIVIDAD:
La conductividad eléctrica es la capacidad de un cuerpo o medio para conducir la corriente eléctrica, es decir, para permitir el paso a través de él de partículas cargadas, bien sean los electrones, los transportadores de carga en conductores metálicos o semimetálicos, o iones, los que transportan la carga en disoluciones de electrolitros.
La conductividad es la inversa de la resistividad, por tanto
 , y su unidad es el S/m (siemens por metro) o Ω-1·m-1. Usualmente la magnitud de la conductividad (σ) es la proporcionalidad entre el campo eléctrico
, y su unidad es el S/m (siemens por metro) o Ω-1·m-1. Usualmente la magnitud de la conductividad (σ) es la proporcionalidad entre el campo eléctrico  y la densidad de corriente de conducción
y la densidad de corriente de conducción  :
:http://www.youtube.com/watch?v=vp4m39Rjqc0&feature=related
SOLVATACION:
La solvatación es el proceso de asociación de moléculas de un disolvente con moléculas o iones de un soluto. Al disolverse los iones en un solvente, se dispersan y son rodeados por moléculas de solvente. A mayor tamaño del ion, más moléculas de solvente son capaces de rodearlo, y más solvatado se encuentra el ion.
IONIZACION:
La ionización es el proceso químicO o físico mediante el cual se producen iones, estos son átomos o moléculas cargadas eléctricamente debido al exceso o falta de electrones respecto a un átomo o molécula neutro. A la especie química con más electrones que el átomo o molécula neutros se le llama anión, y posee una carga neta negativa, y a la que tiene menos electrones catión, teniendo una carga neta positiva. Hay varias maneras por las que se pueden formar iones de átomos o moléculas
PRACTICA.
- Tienen sabor ácido como en el caso del ácido cítrico en la naranja y el limón.
- Cambian el color del papel tornasol azul a rosa, el anaranjado de metilo de anaranjado a rojo y deja incolora a la fenolftaleína.
- Son corrosivos.
- Producen quemaduras de la piel.
- Son buenos conductores de electricidad en disoluciones acuosas.
- Reaccionan con metales activos formando una sal e hidrógeno.
- Reaccionan con bases para formar una sal mas agua.
- Reaccionan con óxidos metálicos para formar una sal mas agua.
OBJETIVO: obtener las propiedades de las sustancias utilizadas y organizarlas en una tabla observando su variación.
MATERIAL:
Cloruro de Na Nitrato de k Azúcar
Cloruro de K Nitrato de Na Talco
Cloruro de Mg Nitrato de S Alcohol
Cloruro de Ca Nitrato de c Agua
Cloruro de Cu Acetona
Aceite
HIPOTESIS: Observaremos que varían las características de cada sustancia dependiendo con el solvente que se convienen.
PROCEDIMIENTO:
1.- Se nos entregara el material proporcionado por la maestra de química
2.-Organizaremos el material
3.- Elaboraremos la tabla para irla llenando conforme vallamos mezclando las sustancias conforme a los resultados
4.-Comenzaremos a mezclar cada sustancia con diferentes solventes.
5.- Agitaremos y observaremos la solubilidad y conductividad de cada sustancia en los diferentes solventes( agua, acetona y alcohol) y los resultados los registraremos en la tabla ya elaborada.
TABLA DE CARACTERISTICAS
Cloruro de: | Estado físico: | Punto de fusión: | Punto de ebullición: | Agua: | Alcohol: | Acetona: | Solo: | En solución: | Tipo de enlace | |||||||||||
Na | Solido | 801°C | 1465°C | Si | No | No | No | Si | Iónico | |||||||||||
K | solido | 368°C | 7400°C | Si | No | No | No | Si | Iónico | |||||||||||
Mg | Solido | 712°C | 1412°C | No | Si | No | No | Si | Iónico | |||||||||||
Ca | Solido | 772°C | 1935°C | Si | No | No | No | Si | Iónico | |||||||||||
Cu | Solido | 422°C | 1367°C | No | Si | Si | No | Si | Iónico | |||||||||||
Nitrato de K | Solido | 334°C | 400°C | No | No | Si | No | No | Iónico | |||||||||||
Nitrato de Na | Solido | 308°C | 380°C | No | No | No | No | No | Iónico | |||||||||||
Nitrato de S | Solido | 115.36°C | 4446°C | No | No | Si | No | No | Covalente | |||||||||||
Nitrato de c | Solido | 3550°C | 4827°C | Si | Si | Si | No | No | Iónico | |||||||||||
Azúcar | Solido | 146°C | 150 | Si | Si | Si | No | No | Covalente | |||||||||||
Talco | solido | 1530°C | no | Si | No | No | No | |||||||||||||
Alcohol | Liquido | -117°C | 78°C | Si | Si | Si | No | No | Covalente | |||||||||||
Agua | Liquido | 0°C | 100°C | Si | Si | Si | No | Si | Cov polar | |||||||||||
Acetona | Liquido | -949°C | 56.3°C | Si | Si | Si | No | No | ||||||||||||
aceite | liquido | -5 | 300°C | no | Si | no | No | no | ||||||||||||
![\mbox{pH} = -\log_{10} \left[ \mbox{a}_{H_3O^+} \right]](http://upload.wikimedia.org/wikipedia/es/math/7/b/7/7b7e772992e9d43888cd421cba60c766.png)


No hay comentarios:
Publicar un comentario